La translocación de carbonatos está gobernada por el balance de reacción entre carbonatos (insolubles) y bicarbonatos (solubles) de acuerdo con la siguiente ecuación:
decarbonatación --------------------------------------------->
CaCO3 (insoluble) + CO2 + H2O <-----> Ca++ + 2HCO3-
<------------------------------------------------ carbonatación
Los parámetros que influencian la reacción son:
![]() Agua
Agua
La enorme importancia de la concentración de agua en el comportamiento de los carbonatos en el suelo se deduce de la ecuación anterior. Un aumento de agua producirá un desplazamiento del equilibrio hacia la derecha, con la consiguiente disolución de los carbonatos, mientras que una disminución producirá la correspondiente precipitación e inmovilización de los carbonatos.
incorporación de agua --> disolución de los carbonatos
disminución de agua --> precipitación de los carbonatos
![]() CO2
CO2
La importancia de la concentración de CO2 en el comportamiento de los carbonatos en el suelo se deduce de la ecuación anterior. Un aumento de CO2 producirá un desplazamiento del equilibrio hacia la derecha con la consiguiente disolución de los carbonatos, mientras que una disminución producirá la correspondiente precipitación e inmovilización de los carbonatos.
aumento del CO2 disuelto --> disolución de los carbonatos
disminución del CO2 disuelto --> precipitación de los carbonatos
La acción del CO2 en la disolución de los carbonatos es de gran importancia ya que la presión parcial de CO2 en el aire del suelo es del orden de diez veces mayor que la de la atmósfera o incluso mayor. Esta acumulación de CO2 es debida a la actividad biológica (acción de las raíces y respiración de los microorganismos) y a la descomposición de la materia orgánica.
|
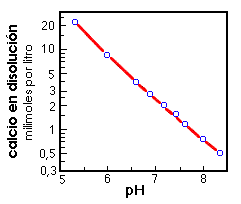
Los cambios en el pH afectarán al sistema ya que al aumentar el contenido de CO2 en agua también aumentará proporcionalmente la acidez y la disolución de los carbonatos tendrá lugar. Lo contrario ocurrirá si aumenta la alcalinidad. aumento del pH --> precipitación de los carbonatos disminución del pH --> disolución de los carbonatos |
 |
|
|
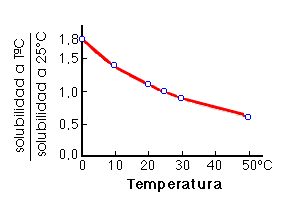
La temperatura afecta al equilibrio ya que el CaCO3 es menos soluble en agua caliente que en agua fría. La solubilidad de los carbonatos decrece cuando aumenta la temperatura y por eso la movilidad de los carbonatos será mayor en climas fríos que en climas cálidos. disminución de la temperatura --> disolución de los carbonatos aumento de la temperatura --> precipitación de los carbonatos |
 |
![]() Sales
Sales
Otro parámetro que influencia la solubilidad de los carbonatos es la concentración de la solución del suelo. El efecto que las sales disueltas tienen en la solubilidad de una sal particular es bien conocido.
Así la presencia de un ión común reduce la solubilidad, mientras que la presencia de otras sales que no tienen ningún ión común con los carbonatos aumenta la solubilidad de la sal particular.
Indice | Introducción | Principio de página | Anterior | Siguiente