Tema 12. Contaminación por sales solubles
2 Naturaleza de las sales solubles
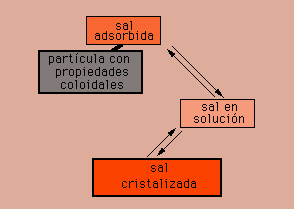
La forma o estado de presentación es variable y estacional. Las sales pueden encontrarse en el suelo de varias formas: precipitadas bajo la forma de cristales, disueltas en la disolución, o bien retenidas, adsorbidas, en el complejo de cambio.
El contenido en sales en cualquiera de estas tres situaciones está cambiando continuamente al ir cambiando la humedad edáfica, pasando las sales de una posición a otra. Así en el:
![]() período seco: la cristalización
aumenta, las sales en solución disminuyen (aunque la solución
se concentra) y aumentan las adsorbidas.
período seco: la cristalización
aumenta, las sales en solución disminuyen (aunque la solución
se concentra) y aumentan las adsorbidas.
![]() período húmedo: el comportamiento
es inverso.
período húmedo: el comportamiento
es inverso.
En cuanto a su composición, estas sales son el resultado de la combinación de unos pocos elementos químicos, fundamentalmente: O, Ca, Mg, Na, K, Cl, S, C, N. Estos elementos necesarios para la formación de las sales son muy frecuentes en la corteza terrestre.
Composición de la corteza terrestre, según Clark (en %) | |
| Oxígeno | 49,13 |
| Silicio | 26,00 |
| Aluminio | 7,45 |
| Hierro | 4,20 |
| Calcio | 3,25 |
| Sodio | 2,40 |
| Magnesio | 2,35 |
| Potasio | 2,35 |
| Hidrógeno | 1,00 |
| Titanio | 0,61 |
| Carbono | 0,35 |
| Cloro | 0,20 |
| Fósforo | 0,12 |
| Azufre | 0,10 |
| Manganeso | 0,10 |
Las sales de las aguas de riego proceden fundamentalmente de la meteorización de las rocas y sedimentos, muy frecuentemente de la disolución de sedimentos salinos o contaminación de aguas freáticas procedentes del mar. Otra parte de sus iones constituyentes, fundamentalmente cloro y azufre proceden de las emanaciones volcánicas.
La secuencia de liberación de los iones constituyentes de las rocas y minerales, su movilidad y su facilidad para acumularse en las aguas, son inversamente proporcionales al coeficiente de energía de estos iones.
Coeficiente de energía, según Fersman | ||||
| ANIONES | CATIONES | |||
| NO3 | 0,18 |
|
K | 0,36 |
| Cl | 0,23 | Na | 0,45 | |
| SO4 | 0,66 | Ca | 1,75 | |
| CO3 | 0,78 | Mg | 2,10 | |
| SiO3 | 2,75 | Al | 4,25 | |
| Fe | 5,15 | |||
Por tanto, los nitratos, cloruros, sulfatos y carbonatos de iones alcalinos y alcalinotérreos, son las sales que con mayor facilidad han de formarse como consecuencia de la meteorización de la corteza terrestre.
Los elementos químicos pueden ser agrupados en cinco categorías de acuerdo con su movilidad durante la meteorización y su capacidad de migración:
Grupo 1. Virtualmente no lavable: Si (en cuarzo)
Grupo 2. Débilmente lavable: Fe, Al, Si
Grupo 3. Lavable: Si, P, Mn
Grupo 4. Fuertemente lavable: Ca, Na, K, Mg, Cu, Co, Zn
Grupo 5. Muy fuertemente lavable: Cl, Br, I, S, C, B
La posibilidad de encontrar estos compuestos en los suelos salinos y aguas salinas es mayor cuanta más alta sea la categoría en que se encuentran clasificados los elementos. Los grupos cuarto y quinto constituyen los principales compuestos acumulados como resultado del proceso de salinización.
Las sales más frecuentemente encontradas son:
CLORUROS: NaCl, CaCl2, MgCl2, KCl
SULFATOS: MgSO4, Na2SO4,
NITRATOS: NaNO3, KNO3
CARBONATOS: Na2 CO3
BICARBONATOS: NaCO3H
Los cloruros junto con los sulfatos son las principales sales formadas en este proceso. El calcio, el magnesio y el sodio son los cationes que mayoritariamente se unen a los cloruros y a los sulfatos para formar las sales, con menor frecuencia se encuentra el potasio y los bicarbonatos, carbonatos y nitratos.
Solubilidad de la sales
Se trata de una propiedad muy importante, pues además de afectar a la movilidad y precipitación, va a regular su máxima concentración en la solución del suelo, y cuanto mayor sea esta, más importante va a ser su efecto perjudicial para los cultivos. Las sales mas tóxicas son, pues, las que presentan elevadas solubilidades, que darán soluciones muy concentradas. Por el contrario las sales con baja solubilidad no representaran ningún problema grave ya que precipitaran antes de alcanzar niveles perjudiciales.
Como puede verse en la siguiente tabla, los cloruros y nitratos son los más solubles, después los bicarbonatos junto a los sulfatos, siendo en general los menos solubles los carbonatos. Por tanto serán estos últimos los primeros en precipitar, seguidos del sulfato cálcico y no serán considerados dentro del concepto de sales solubles, concepto que se refiere a sales muy solubles, concretamente empiezan a partir del carbonato sódico.
Solubilidades en agua de algunas sales a 20° de temperatura, en gramos/litro |
|
| CaCO3 | 0,01 |
| MgCO3 | 0,10 |
| CaSO4.2H2O | 2,40 |
| Na2CO3 | 71,00 |
| Na2SO4.7H20 | 195,00 |
| MgSO4 | 262,00 |
| Ca(HCO3)2 | 262,00 |
| KNO3 | 316,00 |
| NaCl | 360,00 |
| MgSO4.7H20 | 710,00 |
| NaNO3 | 921,00 |
| MgCl2.6H2O | 1.670,00 |
| CaCl2.6H2O | 2.790,00 |
En general, la solubilidad de la sales aumenta con la temperatura. En soluciones complejas, la presencia de sales con iones comunes disminuye la solubilidad de estas sales. Por el contrario, cuando los iones son diferentes se suele aumentar la solubilidad de la sal menos soluble.
En la siguiente tabla (Porta et al., 2003) se reproduce la frecuencia, grados de solubilidad y los efectos tóxicos particulares estas sales.
| Clase | Presencia en los suelos salinos |
Solubilidad |
Toxicidad para las plantas |
| CLORUROS | |||
| Sódico | común |
alta |
+++ |
| Magnésico | común |
alta |
++++ |
| Cálcico | raro |
alta |
++ |
| Potásico | baja |
alta |
+ |
| SULFATOS | |||
| Sódico | común |
muy variable |
++ |
| Magnésico | común |
media |
++++ |
| Potásico | baja |
alta |
+ |
| CARBONATOS | |||
| Sódico | en suelos sódicos |
media |
+++++ |
| BICARBONATOS | |||
| Sódico | en suelos sódicos | media |
++++ |
![]() Cloruros
Cloruros
El cloruro sódico es la sal más frecuente en los suelos salinos, junto con los sulfatos sódico y magnésico, y suele formar parte de las eflorescencias blancas que aparecen en la superficie del suelo durante la estación seca. Su toxicidad es alta.
El cloruro magnésico se acumula en suelos que tienen una salinidad extremadamente alta. Es una sal de toxicidad muy elevada y se puede formar en suelos con alto contenido en NaCl, en los que el Na+ se intercambia con el Mg2+ adsorbido en las posiciones de intercambio:
Partícula adsorbente-Mg + NaCl ----> Partícula adsorbente-Na + MgCl2
Es una sal muy higroscópica, pudiendo absorber humedad del aire. Sus eflorescencias tienen un sabor amargo.
El cloruro cálcico, si bien su solubilidad es muy alta, es una sal muy poco frecuente en suelos debido a la mayor estabilidad de otras sales cálcicas, como los sulfatos o los carbonatos:
CaCl2 + Na2SO4 + 2H2O ----------> 2NaCl (halita)+ CaSO4. 2H2O (yeso)
CaCl2 + Na2CO3 ----------> 2NaCl (halita) + CaCO3 (calcita)
tanto el yeso como el carbonato cálcico precipitan y la reacción progresa hacia la derecha.
El cloruro potásico presenta unas propiedades análogas a las del NaCl, aunque es poco frecuente en los suelos debido a que el K se inmoviliza en el suelo, bien en las estructura de las arcillas de tipo ilita o bien en la biomasa debido a su carácter de macronutriente.
![]() Sulfatos
Sulfatos
El sulfato sódico es frecuente en los suelos salinos. Sus eflorescencias tienen un sabor jabonoso-salado. Su solubilidad se ve afectada fuertemente por la temperatura, lo que hace que tienda a concentrarse en la superficie del suelo, ya que durante el período cálido asciende a la superficie del suelo formando parte de las eflorescencias (rasgo muy típico de los suelos salinos) y durante el período húmedo, que en nuestro clima coincide con el frío, se lava menos que las otras sales. Mucho menos tóxica que el sulfato magnésico.
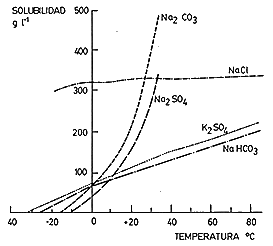
(Kovda, 1967 en Porta et al., 2003)
El sulfato magnésico es una sal frecuente en los suelos salinos, muy soluble y altamente tóxica.
El sulfato potásico, es escaso, en general, en los suelos salinos, por lo que no suele ser responsable de salinizaciones en condiciones naturales, aunque puede crear problemas cuando se hace un mal uso de los abonos, generalmente en invernaderos. Junto con el KCl son las sales menos tóxicas.
![]() Carbonatos y bicarbonatos
Carbonatos y bicarbonatos
Los carbonatos y bicarbonatos sodicos presentan una solubilidad elevada, aunque dependiendo de la temperatura. Su presencia en suelos en cantidades relativamente elevadas implica condiciones de alcalinidad (pH > 9) debido a la formación de OH- :
Na2CO3 + H2O ----------> 2Na+ + HCO3- + OH-
HCO3- + H2O ---------> H2CO3 + OH-
La presencia de otras sales solubles en la solución del suelo limita la formación del carbonato y bicarbonato sódico, por lo que estas sales suelen ser abundantes cuando la salinidad total es baja, ya que se pueden producir reacciones como:
Na2CO3 + CaSO4 -------> CaCO3 + Na2SO4
Na2CO3 + MgSO4 -------> MgCO3 + Na2SO4
en las que el CaCO3 y el MgCO3 son poco solubles y precipitan, con lo que las reacciones se desplazan hacia la derecha. En presencia de NaCl, la solubilidad del carbonato y bicarbonato sódico disminuye igualmente por efecto del ión común.
La fuerte alcalinidad que originan crea condiciones poco aptas para el crecimiento de los cultivos, pudiéndose presentar efectos desfavorables a concentraciones bajas (0,05-0,1 %). El bicarbonato sódico es menos alcalino que el carbonato, debido a que el ácido carbónico neutraliza en parte el efecto alcalino. Su solubilidad es también menor que la del carbonato.
![]() Nitratos
Nitratos
El nitrato sódico es una sal muy soluble y tóxica, aunque, en general, muy poco frecuente y rara vez supera el 0,05 %. Se han citado en cantidades elevadas en desiertos muy áridos de Chile, Perú, India, Arabia...
Otras sales no solubles frecuentes en los suelos salinos
![]() Carbonato cálcico y carbonato magnésico
Carbonato cálcico y carbonato magnésico
El carbonato cálcico, al ser de muy baja solubilidad, no tienen efectos perjudiciales para las plantas. Es un compuesto muy abundante en suelos.
El carbonato magnésico es mucho más soluble que el cálcico, sin embargo es muy rara su presencia en los suelos.
![]() Sulfato cálcico
Sulfato cálcico
El yeso (CaSO4.2H2O) es una sal que por su baja solubilidad tampoco es perjudicial para las plantas. Junto con los carbonatos, es un mineral muy frecuente en los suelos salinos (figura 1).
![]() En resumen. En los suelos
salinos predominan los cloruros y sulfatos de Ca y Ma, y en menor medidad de
Na, mientras que el los sódicos son los carbonatos y bicarbonatos
sódicos los que predominan.
En resumen. En los suelos
salinos predominan los cloruros y sulfatos de Ca y Ma, y en menor medidad de
Na, mientras que el los sódicos son los carbonatos y bicarbonatos
sódicos los que predominan.
La solubilidad de las sales, y por tanto su estado y movilidad, está muy influenciada por la temperatura (aunque unas mucho mas que otras). Por ello presentan un comportamiento muy dinámico, presentando importantes variaciones estacionales (unas determinadas sales se encontrarán precipitadas en invierno y solubles y móviles en el verano; además la composición de la disolución del suelo será distinta en la estación fría de la de la estación cálida).
Mineralogía
Las formas mineralogicas en las que se acumulan estas sales en los suelos son muy variables, ya que dependen de la temperatura y de la humedad. Existe una gran variedad de especies minerales que se diferencian en el grado de hidratación de su molécula, así como por la posibilidad de que se formen sales mixtas en las que intervienen más de un catión. Durante un ciclo de humectación y secado, muy común en los suelos salinos, pueden cambiar las especies cristalinas aunque no se modifique la composición iónica global. Así, el Na2SO4 se puede presentar en forma de tenardita (deshidratado), mirabilita (con 10 moléculas de H2O) o bloedita (sal mixta). Una revisión bibliográfica nos proporcionaría de 30 a 40 minerales para estos suelos, pero en general los estudios han estado dirigidos a cuantificar el contenido en sales y sus efectos en el suelo y en las plantas y se ha investigado poco en la identificación de las especies mineralógicas presentes.
Los minerales más frecuentes son:
Dentro de los cloruros:
![]() Halita ClNa
Halita ClNa
Dentro de los sulfatos:
![]() Hemihidrita CaSO4.1/2H20
Hemihidrita CaSO4.1/2H20
![]() Mirabilita Na2SO4.10H20
Mirabilita Na2SO4.10H20
![]() Tenardita Na2SO4
Tenardita Na2SO4
![]() Epsomita MgSO4.7H20
Epsomita MgSO4.7H20
![]() Hexahidrita MgSO4.6H20
Hexahidrita MgSO4.6H20
![]() Bloedita Na2Mg(SO4)2.4H20
Bloedita Na2Mg(SO4)2.4H20
Dentro de los carbonatos:
![]() Nahcolita NaHCO3
Nahcolita NaHCO3
![]() Trona Na3CO3HCO3.2H2O
Trona Na3CO3HCO3.2H2O
![]() Soda Na2CO3.10H20
Soda Na2CO3.10H20
Programa | Lección 12 | Anterior | Siguiente | Principio página