Lección 5. PROPIEDADES FISICOQUIMICAS
Si quieres pasar un rato divertido con los suelos abre Buscasol
1.1 Teorías del intercambio iónico
1.2 Capacidad de cambio de cationes
1.3 Capacidad de cambio de aniones
1.4 Importancia de la capacidad de cambio iónico
3 Potencial de oxidación - reducción
4 TEST
Desde muy antiguo se sabía que al pasar un disolución a través de un material pulverulento se perdía parte de la concentración de la disolución (si la disolución era coloreada se decoloraba). Por ejemplo era muy conocido el hecho de que los suelos pueden extraer sales y colorantes de una solución. Hoy día estas reacciones se justifican por un intercambio de iones entre la solución y el material sólido.
Se define el cambio iónico como los procesos reversibles por los cuales las partículas sólidas del suelo adsorben iones de la fase acuosa liberando al mismo tiempo otros iones en cantidades equivalentes, estableciéndose el equilibrio entre ambas fases.

Según el tipo de iones que se intercambien,
Cambio de cationes: Suelo-M + X+ -----> Suelo-X + M+
Cambio de aniones: Suelo-N + Y- -----> Suelo-Y + N-
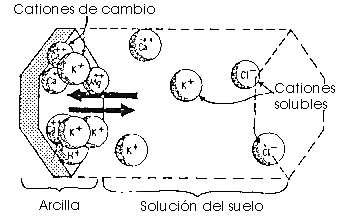
Es un proceso dinámico que se desarrolla en la superficie de las partículas. Como los iones adsorbidos quedan en posición asimilable constituyen la reserva de nutrientes para las plantas.
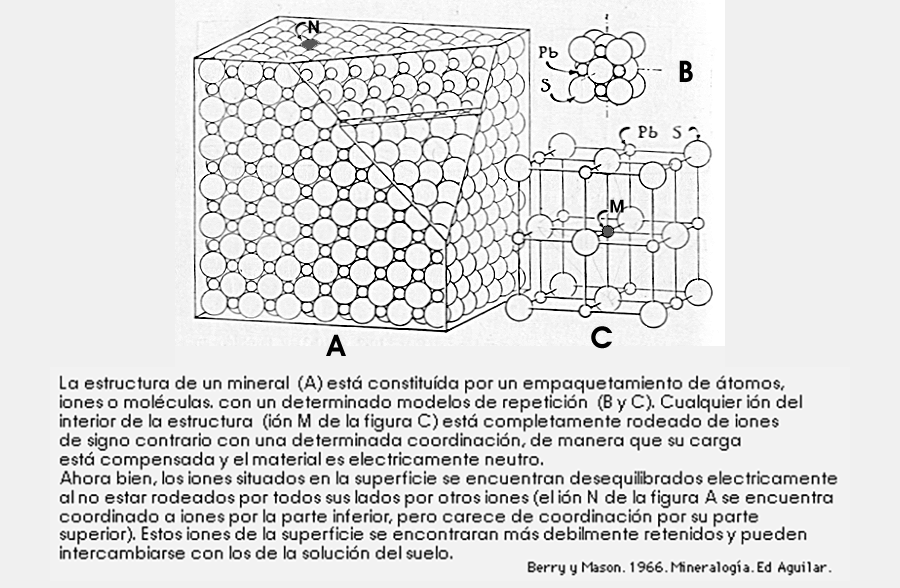
Las causas que originan el intercambio iónico son los desequilibrios eléctricos de las partículas del suelo. Para neutralizar las cargas se adsorben iones de la disolución, que se pegan a la superficie de las partículas. Quedan débilmente retenidos sobre las partículas del suelo y se pueden intercambiar con la solución del suelo.
Cuanto más superficie tenga el material y más desequilibrada se encuentre, más iones se fijaran.
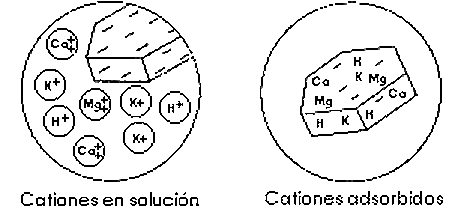
Fíjate que los cationes y aniones en el suelo pueden estar dentro de la estructura interna de las partículas, adsorbidos sobre sus superficies y solubles en la disolución del suelo. Los mecanismos de cambio afectan sólo a los dos últimos.
1.1 Teorías del intercambio iónico
Existen tres teorías que tratan de explicar el porqué de este proceso.
![]() Red cristalina. Considera las partículas de los minerales
como sólidos iónicos. Los iones de los bordes están débilmente
retenidos por lo que pueden abandonar la estructura y pueden cambiarse con los
de la solución del suelo.
Red cristalina. Considera las partículas de los minerales
como sólidos iónicos. Los iones de los bordes están débilmente
retenidos por lo que pueden abandonar la estructura y pueden cambiarse con los
de la solución del suelo.
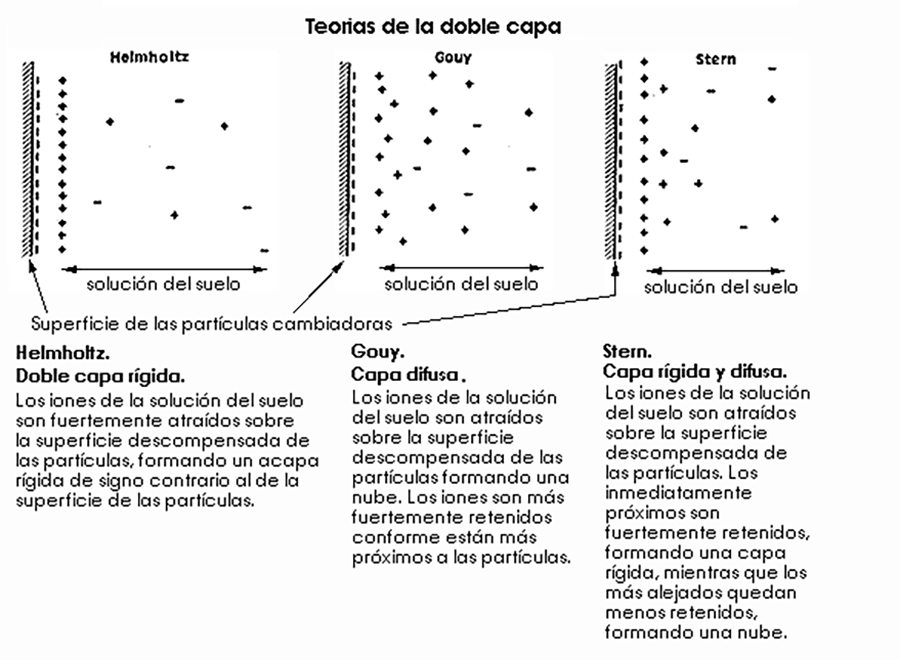
![]() Doble capa eléctrica. Considera el contacto entre el sólido
y la fase líquida como un condensador plano. Entre el metal (el sólido)
y el electrólito (la disolución) existe una diferencia de potencial
que atrae a los iones de la solución del suelo. Se forma una doble capa
eléctrica formada por los iones del sólido y los atraídos
en la solución.
Doble capa eléctrica. Considera el contacto entre el sólido
y la fase líquida como un condensador plano. Entre el metal (el sólido)
y el electrólito (la disolución) existe una diferencia de potencial
que atrae a los iones de la solución del suelo. Se forma una doble capa
eléctrica formada por los iones del sólido y los atraídos
en la solución.
![]() Membrana semipermeable. La interfase sólido-líquido
actúa como una membrana semipermeable que deja pasar los iones de la
solución y a los de la superficie de las partículas pero no a
los del interior de los materiales.
Membrana semipermeable. La interfase sólido-líquido
actúa como una membrana semipermeable que deja pasar los iones de la
solución y a los de la superficie de las partículas pero no a
los del interior de los materiales.
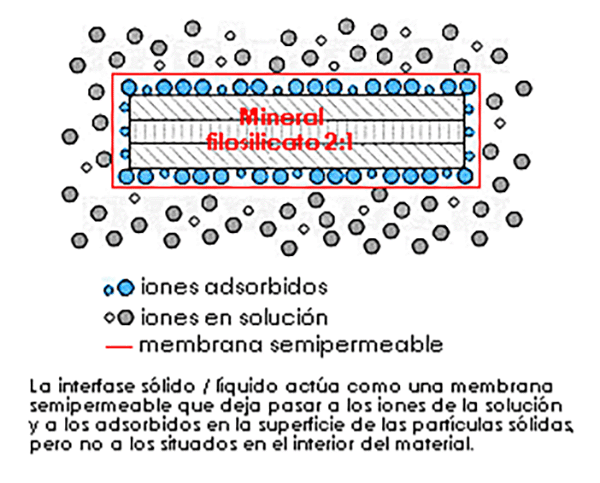
Básicamente las tres teorías son compatibles y simplemente se trata de enfoques distintos:
![]() iones débilmente retenidos para la teoría
cristalina.
iones débilmente retenidos para la teoría
cristalina.
![]() desequilibrios eléctricos para la teoría
de la doble capa eléctrica.
desequilibrios eléctricos para la teoría
de la doble capa eléctrica.
![]() diferentes concentraciones para la teoría
de la membrana semipermeable.
diferentes concentraciones para la teoría
de la membrana semipermeable.
1.2 Capacidad de cambio de cationes
La capacidad de cambio de cationes (CCC), también llamada capacidad de intercambio de cationes (CIC), es más importante que la de los aniones y es por tanto la mejor conocida.
En el suelo son varios los materiales que pueden cambiar cationes. Los principales cambiadores son las arcillas y la materia orgánica (los dos materiales presentan propiedades coloidales).
Las causas de la capacidad de cambio de cationes de las arcillas son:
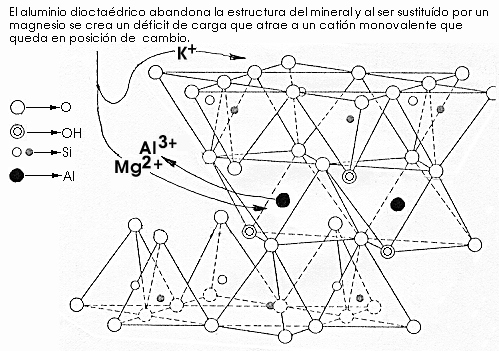
![]() Sustituciones
atómicas dentro de la red.
Sustituciones
atómicas dentro de la red.
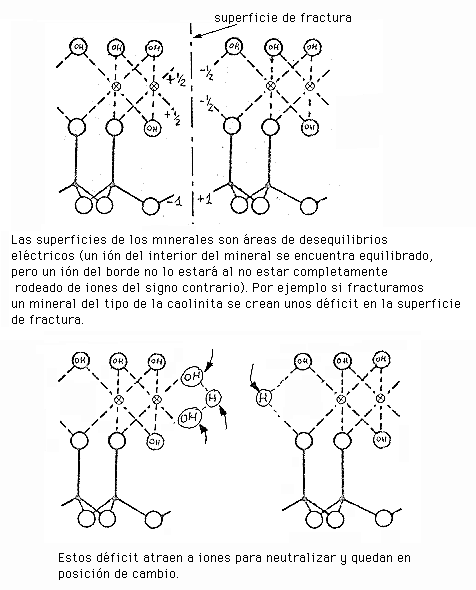
![]() Existencia de bordes (superficies descompensadas).
Existencia de bordes (superficies descompensadas).
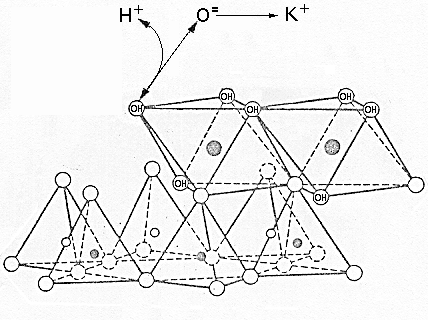
![]() Disociación
de los OH de las capas basales.
Disociación
de los OH de las capas basales.
![]() Enlaces de Van der Waals.
Enlaces de Van der Waals.
En las arcillas, además de en su superficie, los iones pueden entrar entre las láminas.
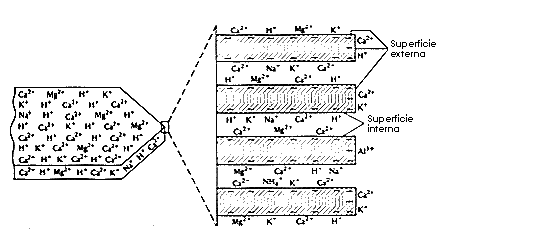
Las causas de la capacidad de cambio de materia orgánica son:
![]() Disociación de los OH.
Disociación de los OH.
![]() Disociación de los COOH.
Disociación de los COOH.

En cuanto a los factores que hacen que un suelo tengan una determinada capacidad de cambio de cationes son varios.
![]() Tamaño de las partículas. Cuanto
más pequeña sea la partícula, más representará su superficie frente al volumen total de la partícula y mas grande será la
capacidad de cambio, por tanto las CCC de las distintas fracciones serán:
Tamaño de las partículas. Cuanto
más pequeña sea la partícula, más representará su superficie frente al volumen total de la partícula y mas grande será la
capacidad de cambio, por tanto las CCC de las distintas fracciones serán:
arcillas > limos > arenas
![]() Naturaleza de las partículas . La composición
y estructura de las partículas influirá en las posibilidades de
cambio de sus cationes. Así la capacidad de cambio catiónico (CCC)
de algunos de los materiales más comunes en los suelos los representamos
en la siguiente tabla.
Naturaleza de las partículas . La composición
y estructura de las partículas influirá en las posibilidades de
cambio de sus cationes. Así la capacidad de cambio catiónico (CCC)
de algunos de los materiales más comunes en los suelos los representamos
en la siguiente tabla.
| Naturaleza de la partícula | CCC, meq/100g |
| cuarzo y feldespatos | 1-2 |
| oxidos e hidróx. Fe y Al | 4 |
| caolinita | 3-15 |
| ilita y clorita | 10-40 |
| montmorillonita | 80-150 |
| vermiculita | 100-160 |
| materia orgánica | 300-500 |
Como vemos la naturaleza del cambiador confiere mayor a menor capacidad de cambio. Cada 1% de arcilla puede repercutir en medio miliequivalente en la capacidad de cambio de cationes del suelo. Si en vez de arcilla nos referimos a la materia orgánica, cada 1% puede repercutir en 2 miliequivalentes más (miliequivalente / 100gr = cmol(+)kg-1).
Los valores normales en suelos oscilan entre 4 y 40 cmol(+)kg-1
![]() Tipo de cationes cambiables. La capacidad de
cambio de cationes se ajusta al total de cargas negativas de la partícula, o lo que es lo mismo
representa el número de cargas positivas que incorporarán los cationes que vienen
a fijarse.
Tipo de cationes cambiables. La capacidad de
cambio de cationes se ajusta al total de cargas negativas de la partícula, o lo que es lo mismo
representa el número de cargas positivas que incorporarán los cationes que vienen
a fijarse.
No obstante, la naturaleza de los cationes de cambio pueden modificar el valor de la capacidad de cambio, aumentándola o disminuyéndola, en función de su carga y de su tamaño. Los cationes divalentes, trivalentes... al adsorberse aumentan la capacidad de cationes de cambio
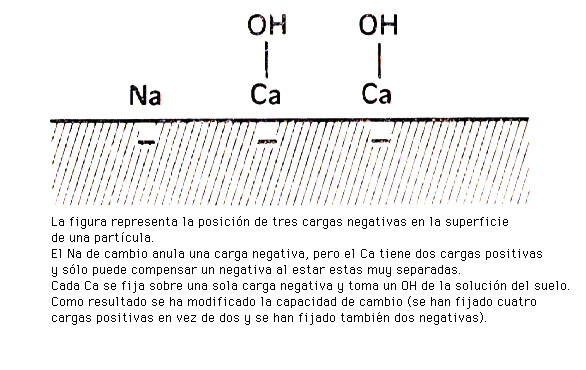
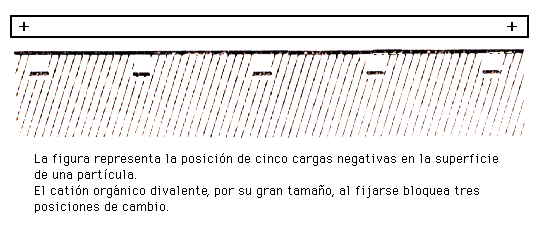
mientras que los cationes de gran tamaño (radicales orgánicos) disminuyen la CCC al bloquear, por su tamaño, posiciones de cambio.
Los cationes que frecuentemente ocupan las posiciones de cambio en los suelos son: Ca2+, Mg2+, K+, Na+, H+, Al3+, Fe3+, Fe2+, NH4+, Mn2+, Cu2+ y Zn2+.
La intensidad con la que los cationes son adsorbidos depende de la carga y radio del ión hidratado. Al aumentar la carga, aumenta la fuerza de unión con el adsorbente. Así los cationes trivalentes tienen una más alta capacidad de fijación en el complejo adsorbente. Los M3+ se fijan preferentemente (alto poder de adsorción) a los M2+ (que son desplazados a la solución, es decir sufren la desorción) y estos a su vez desplazan a los M+
Una secuencia de menor a mayor capacidad de fijación (menor a mayor poder de adsorción) será,
M+< M2+< M3+
Otro factor importante es el radio del ión hidratado. La esfera de hidratación impide que el catión se aproxime a la superficie del adsorbente, por lo que los iones con menor grado de hidratación tendrán mayor probabilidad de ser adsorbidos y lo serán por medio de una unión más fuerte.
La secuencia de adsorción para los monovalentes será:
Li+ < Na+ < K+ < NH4+ < Rb+ < Cs+ < H+
y para los divalentes:
Mg2+ < Ca2+ < Sr2+ < Ba2+
También influirá en el poder de adsorción:
a. Concordancia de las dimensiones de los cationes adsorbidos con los de la red del cambiador
b. Grado de saturación: un cantión de cambio es más difícil de reemplazar cuando su concentración en la superficie del adsorbente disminuye.
c. Iones complementarios: Cuando el grado de saturación en bases es superior al 70% en una mezcla de iones se adsorbe primero el que tiene mayor energía de enlace.
![]() pH. Los suelos presentan distinta capacidad
de cambio en función del pH. A pH bajos los hidrogeniones están
fuertemente retenidos en las superficies de las partículas, pero a pH
altos los H de los grupos carboxílicos primero y de los OH después,
se disocian y los H+ pueden ser intercambiados por cationes. Esto es la consecuencia de que la capacidad de cambio de
cationes aumente con el pH.
pH. Los suelos presentan distinta capacidad
de cambio en función del pH. A pH bajos los hidrogeniones están
fuertemente retenidos en las superficies de las partículas, pero a pH
altos los H de los grupos carboxílicos primero y de los OH después,
se disocian y los H+ pueden ser intercambiados por cationes. Esto es la consecuencia de que la capacidad de cambio de
cationes aumente con el pH.
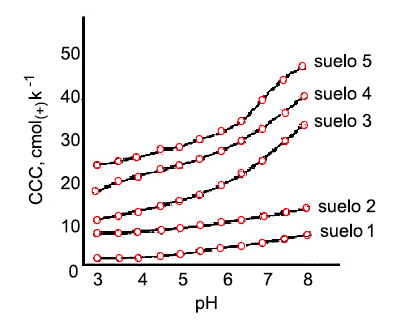
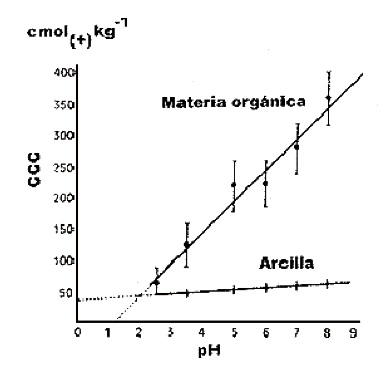
La materia orgánica es mucho más sensible a los cambios de la CCC con el pH que la arcilla.
En los suelos ácidos predominan H+ y Al3+, en los suelos alcalinos predominan las bases fundamentalmente el Na+ y en los neutros el Ca2+.
![]() Grado de saturación. La relación en el complejo de cambio entre los cationes
y el H+ + Al3+ y el resto, expresado en %, representa el grado de saturación
Grado de saturación. La relación en el complejo de cambio entre los cationes
y el H+ + Al3+ y el resto, expresado en %, representa el grado de saturación
grado de saturación : V = (S/T)x100
siendo, T = capacidad de cambio de cationes. Mide la cantidad de bases de cambio (T = S + Al3++ H+)
S = Ca2+ + Mg2+ + Na+ + K+.
Cuando V > 50% se dice que el suelo está saturado (en bases).
Si V < 50% el suelo se encuentra desaturado y las posiciones de cambio están ocupadas principalmente por H+ y Al3+; se trata de un medio pobre en nutrientes.
1.2 Capacidad de cambio de aniones (CCI o CII, intercambio de iones)
Está menos representado en los suelos que el cambio de cationes. Importante en suelos de carga variable (ricos en óxidos hidratados de Al(III) y Fe(III).
Los aniones y las moléculas de comportamiento aniónico mas importantes son:
Aniones: Cl-, HCO3-, NO3-, SO42-, H2PO4-, HPO42-, OH- y F-
Micronutrientes: H2BO3- y MoO42-
Metales pesados: CrO42- y HAsO42-
Los factores que influyen en las reacciones de cambio iónico son:
![]() Carga y concentración del anión. La CII aumenta con la carga y la concentración.
Carga y concentración del anión. La CII aumenta con la carga y la concentración.
![]() Variedad de los cationes intercambiables. Los cationes con carga múltiple y más fuertemente adsorbidos excluyen un menor número de aniones.
Variedad de los cationes intercambiables. Los cationes con carga múltiple y más fuertemente adsorbidos excluyen un menor número de aniones.
![]() pH. Si disminuye (en suelos con carga dependiente del pH) también disminuye la repulsión.
pH. Si disminuye (en suelos con carga dependiente del pH) también disminuye la repulsión.
![]() Presencia de otros aniones. La presencia de aniones fuertemente adsorbidos aumenta la repulsión aniónica.
Presencia de otros aniones. La presencia de aniones fuertemente adsorbidos aumenta la repulsión aniónica.
![]() Naturaleza y carga de la superficie del coloide. Los suelos montmorilloníticos presentan mayor repulsión aniónica que los caoliníticos.
Naturaleza y carga de la superficie del coloide. Los suelos montmorilloníticos presentan mayor repulsión aniónica que los caoliníticos.
1.4 Importancia de la capacidad de cambio
![]() Controla la disponibilidad de nutrientes para
las plantas: K++, Mg2+, Ca2+, entre otros.
Controla la disponibilidad de nutrientes para
las plantas: K++, Mg2+, Ca2+, entre otros.
![]() Interviene en los procesos de floculación
- dispersión de arcilla y por consiguiente en el desarrollo de la estructura
y estabilidad de los agregados.
Interviene en los procesos de floculación
- dispersión de arcilla y por consiguiente en el desarrollo de la estructura
y estabilidad de los agregados.
![]() Determina el papel del suelo como depurador
natural al permitir la retención de elementos contaminantes incorporados
al suelo.
Determina el papel del suelo como depurador
natural al permitir la retención de elementos contaminantes incorporados
al suelo.
_______________
Ninguna de las imágenes de esta página son originales mías; lamento que en sólo en un caso recuerde su procedencia.
Programa | Lección 5 | Anterior | Siguiente | Principio página