Lección 5. PROPIEDADES FISICOQUIMICAS
(continuación)
2 Acidez/basicidad del suelo
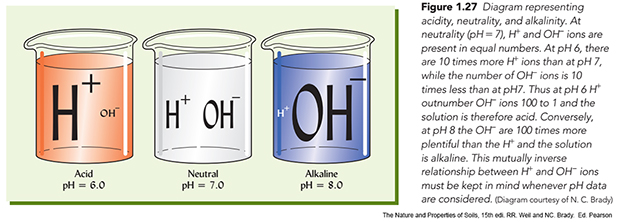
La acidez del suelo representa la concentración en hidrogeniones de la solución del suelo. El agua pura presenta las mismas concentraciones de H+ que de OH- disueltos. Cuando se produce un desequilibrio, por ejemplo, si la concentración de H+ aumenta la de OH- disminuye en la misma proporción. La acidez/basicidad de los suelos se mide por la concentración de H+ presentes. Estas concentraciones son tan bajas que para representar las medidas se utiliza una escala logaritmica. Concretamente por el pH que es el logaritmo negativo de la concentración de hidrogeniones
pH = - log [H+]
Aunque esta fórmula te puede parecer compleja no te preocupes pues hay un aparatito (peachímetro) que hace el trabajo por tí, basta introducir unos electrodos en el suelo y medir el resultado en un escala. Lo que si debes recordar es que según esta fórmula un pH de 7 representa una concentración de H+ de 10 elevado a menos 7 (o sea 0,0000001) y que cada unidad de la escala de pH representa una concentración de 10 veces. Así un pH de 6 representa una concentración de H+ diez veces mayor que la de un pH de 7.
Básicamente se establecen tres grados en la acidez de los suelos. Para valores de pH=7 las concentraciones de H+ y OH- están equilibradas y se habla de suelos neutros (pH entre 7,5 y 6,5). Para valores inferiores a pH de 6,5 los suelos son ácidos (los H+ predominan sobre los OH-) y por encima de 7,5 tenemos los suelos básicos en los que predominan los OH-. Frecuentemente se reduce el término de suelos básicos para las moderadas concentraciones de OH- y para las concentraciones extremas se establece el término de suelos alcalinos, con valores de pH superiores a 8,5.
Si te hablan de la reacción del suelo se están refiriendo a la acidez/basicidad. En los suelos los pH se sitúan en una escala que va del valor 3 al 12, frecuentemente entre 5 y 9.
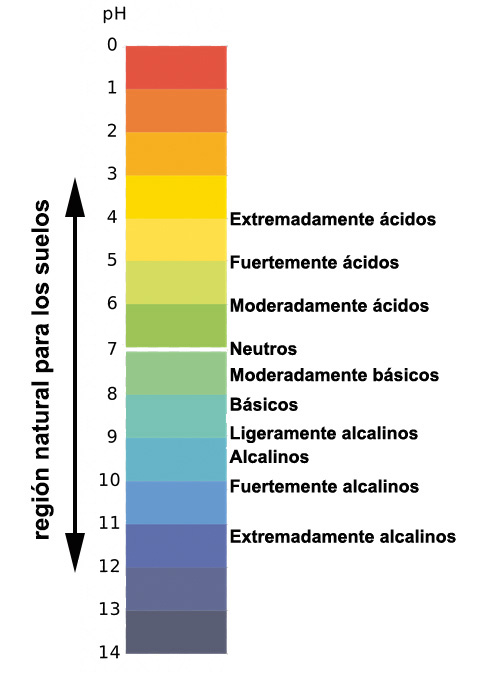
Los suelos ácidos predominan en las regiones de clima húmedo pues las lluvias se infiltran en el suelo y arrastran a las bases disueltas fuera del perfil, mientras que en los climas secos abundan los suelos básicos y alcalinos; si las rocas de las regiones áridas contienen carbonatos de Ca se forman suelos básicos con pH moderadamente básicos pero si el Na es predominante se forman los suelos alcalinos con pH de valores extremadamente altos.
La acidez/basicidad de un suelo va a depender del balance entre la producción de H+ y su eliminación.
Los H+ del suelo pueden proceder de muy distintos orígenes
![]() Las precipitaciones atmosféricas. La lluvia al atravesar las atmósfera disuelve parte del C02 de esta y se acidifica. Por otra parte frecuentemente contiene ácidos como H2SO4 y HNO3 de fuerte reacción ácida.
Las precipitaciones atmosféricas. La lluvia al atravesar las atmósfera disuelve parte del C02 de esta y se acidifica. Por otra parte frecuentemente contiene ácidos como H2SO4 y HNO3 de fuerte reacción ácida.
![]() CO2 producido en el propio suelo. El CO2 se concentra en el suelo como resultado de la respiración de microorganismos aeróbicos, fauna y raíces.
CO2 producido en el propio suelo. El CO2 se concentra en el suelo como resultado de la respiración de microorganismos aeróbicos, fauna y raíces.
![]() Descomposición de la materia orgánica. Al descomponerse la materia orgánica del suelo se libera CO2 y muchos ácidos orgánicos como los cítricos, málicos, carboxílicos, fenólicos... Por otra parte los compuestos orgánicos liberados pueden formar complejos organominerales solubles con las bases del suelo como el Ca, Na... que las movilizan y son lavadas del perfil.
Descomposición de la materia orgánica. Al descomponerse la materia orgánica del suelo se libera CO2 y muchos ácidos orgánicos como los cítricos, málicos, carboxílicos, fenólicos... Por otra parte los compuestos orgánicos liberados pueden formar complejos organominerales solubles con las bases del suelo como el Ca, Na... que las movilizan y son lavadas del perfil.
![]() Exudación de H+ por las raíces. Las raíces absorben nutrientes del suelo liberando H+ en el intercambio iónico.
Exudación de H+ por las raíces. Las raíces absorben nutrientes del suelo liberando H+ en el intercambio iónico.
![]() Reacciones de oxidación. Compuestos como el N, S, Fe y Mn que al oxidarse producen la liberación de importantes cantidades de H+.
Reacciones de oxidación. Compuestos como el N, S, Fe y Mn que al oxidarse producen la liberación de importantes cantidades de H+.
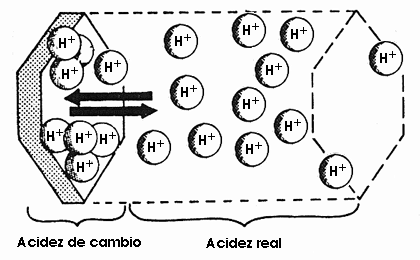
En los suelos los hidrogeniones se encuentran en la solución, pero también existen en el complejo de cambio, o sea hay dos tipos de acidez.
![]() Acidez activa o actual o real es debida a los H+ presentes en la solución del suelo. Se mide con el peachímetro en una mezcla de suelo agua en una proporción 1:2,5.
Acidez activa o actual o real es debida a los H+ presentes en la solución del suelo. Se mide con el peachímetro en una mezcla de suelo agua en una proporción 1:2,5.
![]() Acidez potencial o de reserva o intercambiable. Debida a los hidrogeniones y a los iones de aluminio presentes en el complejo de cambio. Representa una reserva de protones que por intercambio iónico pueden pasar a posiciones activas en la solución del suelo. Para medirla se han de desplazar por otros cationes a todos los hidrogeniones del complejo de cambio. Para ello se suele utilizar una solución de KCl. La acidez de cambio es mucho mas grande que la activa, sin embargo esta es mucho más importante porque va a controlar la solubilidad de los iones en la solución del suelo y el grado de asimilación de los nutrientes por los organismos del suelo. La potencial es importante desde el punto de vista de que representa el almacén para ir reponiendo los protones conforme se vayan perdiendo. Precisamente esta acidez de cambio hace que el pH de un suelo sea sea una característica muy estable y que cuando se quiere corregir la acidez de un suelo haya de utilizar una gran cantidad de productos enmendantes.
Acidez potencial o de reserva o intercambiable. Debida a los hidrogeniones y a los iones de aluminio presentes en el complejo de cambio. Representa una reserva de protones que por intercambio iónico pueden pasar a posiciones activas en la solución del suelo. Para medirla se han de desplazar por otros cationes a todos los hidrogeniones del complejo de cambio. Para ello se suele utilizar una solución de KCl. La acidez de cambio es mucho mas grande que la activa, sin embargo esta es mucho más importante porque va a controlar la solubilidad de los iones en la solución del suelo y el grado de asimilación de los nutrientes por los organismos del suelo. La potencial es importante desde el punto de vista de que representa el almacén para ir reponiendo los protones conforme se vayan perdiendo. Precisamente esta acidez de cambio hace que el pH de un suelo sea sea una característica muy estable y que cuando se quiere corregir la acidez de un suelo haya de utilizar una gran cantidad de productos enmendantes.
La acidez activa y la potencial se encuentran en equilibrio dinámico intercambiándose constantemente los protones.
 *
*
Si se eliminan H+ de la solución se liberan otros tantos H+ adsorbidos. Como consecuencia el suelo muestra una fuerte resistencia a cualquier modificación de su pH, está fuertemente tamponado.
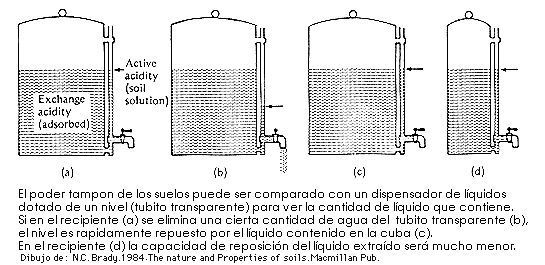
![]() Acidez total, es la suma de la acidez actual mas la intercambiable. Se determina mediante una valoración con una base hasta la neutralización.
Acidez total, es la suma de la acidez actual mas la intercambiable. Se determina mediante una valoración con una base hasta la neutralización.
![]() Naturaleza del material original. Las rocas se meteorizan y liberan los iones constituyentes de sus minerales que pasan a la solución del suelo condicionando el pH de este, según
que la roca sea de reacción ácida (granito) o básica (caliza). Las rocas con carbonatos como las calizas, dolomías y margas dan suelos de pH básico alrededor de 7,5; por el contrario los granitos y la arenisca silíceas dan suelos con pH ácidos, generalmente entre 4,8 y 5,6.
Naturaleza del material original. Las rocas se meteorizan y liberan los iones constituyentes de sus minerales que pasan a la solución del suelo condicionando el pH de este, según
que la roca sea de reacción ácida (granito) o básica (caliza). Las rocas con carbonatos como las calizas, dolomías y margas dan suelos de pH básico alrededor de 7,5; por el contrario los granitos y la arenisca silíceas dan suelos con pH ácidos, generalmente entre 4,8 y 5,6.
![]() Factor biótico. Los residuos de la actividad
orgánica son de naturaleza ácida. El humus es de reacción ácida, tanto más cuanto menos humificado se encuentre.
Factor biótico. Los residuos de la actividad
orgánica son de naturaleza ácida. El humus es de reacción ácida, tanto más cuanto menos humificado se encuentre.
![]() Clima. Los climas húmedos originan suelos con arcillas de baja actividad (tipo caolinita) que tienen poca retención de bases, son de fácil lavado por las abundantes precipitaciones y por consiguiente dan suelos ácidos. Por el contrario, los climas áridos tienen arcillas de alta actividad (esmectitas y vermiculitas) que retienen fuertemente las bases, soportan escaso lavado y dan suelos básicos.
Clima. Los climas húmedos originan suelos con arcillas de baja actividad (tipo caolinita) que tienen poca retención de bases, son de fácil lavado por las abundantes precipitaciones y por consiguiente dan suelos ácidos. Por el contrario, los climas áridos tienen arcillas de alta actividad (esmectitas y vermiculitas) que retienen fuertemente las bases, soportan escaso lavado y dan suelos básicos.
Las precipitaciones tienden a acidificar al suelo y desaturarlo al intercambiar los H+ del agua de lluvia por los Ca2+, Mg2+, K+, Na+... de los cambiadores.<
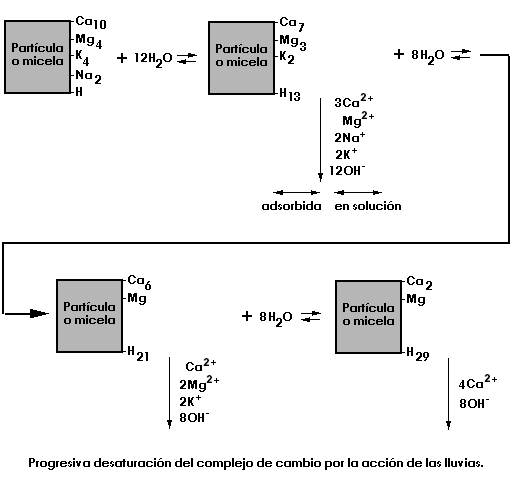
![]() Complejo adsorbente. Según que esta saturado
con cationes de reacción básica (Ca2+, Mg2+...) o de reacción
ácida (H+ o Al3+). También dependiendo de la naturaleza del cambiador
variará la facilidad de liberar los iones adsorbidos.
Complejo adsorbente. Según que esta saturado
con cationes de reacción básica (Ca2+, Mg2+...) o de reacción
ácida (H+ o Al3+). También dependiendo de la naturaleza del cambiador
variará la facilidad de liberar los iones adsorbidos.
El tipo de cationes adsorbidos en las superficies del complejo de cambio varía sensiblemente con la acidez/basicidad del suelo.
En los suelos ligeramente ácidos a ligeramente básicos de las regiones húmedas el Ca++ predomina en el complejo de cambio, llegando a alcanzar una saturación efectiva >80%. La saturación del Mg++ es mucho más baja (15-5%). Menos aún para el K+ (5-2-%) y Na+ (2%).
En los suelos fuertemente ácidos el Al+++ reemplaza a los cationes básicos (Ca++, Mg++, K+ y Na), con valores normales que van del 60 al 90% conforme el pH va decreciendo.
En los suelos fuertemente básicos (llamados generalmente alcalinos) es el Na+ el predominante junto a al Ca++.
Las relaciones entre el pH del suelo, la capacidad de intercambio catiónico y la saturación de bases se representan esquemáticamente en la figura 5.15.
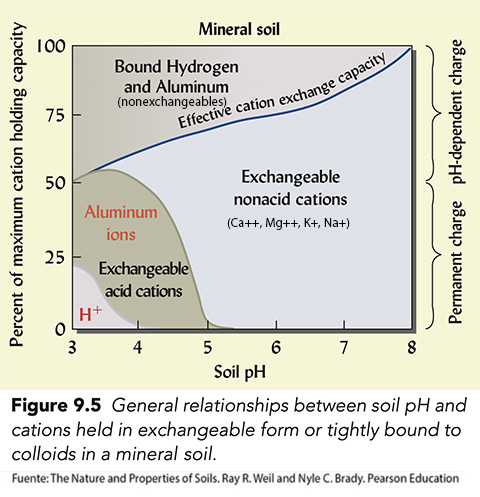
El Al juega un papel muy importante en la acidez de los suelos. Los H+ de la solución del suelo se adsorben en la superficie de los minerales y acaban atacando por medio del intercambio de iones. Las arcillas saturadas con H+ no son estables y se descomponen. El Al que es extraordinariamente abundante en los minerales pasa de estar inmovilizado, bloqueado, en la estructura del mineral a ocupar las posiciones de cambio que tenían los H+ o directamente a la solución dels suelo. El Al+++ con el H2O tiende a hidrolizarse combinándose con los OH- y liberando H+. El Al en suelos básicos se encuentra totalmente precipitado como Al(OH)3 pero en los medios ácidos tiende a forma aluniohidróxidos con cargas negativas que se fijan fuertemente en las posiciones de cambio + bloquendo estas posiciones y en consecuencia disminuye la capacidad de cambio efectiva del suelo. El Al+++, además del H+, es considerado como catión ácido y ambos han de ser evaluados al considerar la acidez total de un suelo.
Influye en las propiedades físicas y químicas.
![]() Propiedades físicas. Los pH neutros son los mejores
para las propiedades físicas de los suelos. A pH muy ácidos
hay una intensa alteración de minerales y la estructura se vuelve
inestable. En pH alcalino, la arcilla se dispersa, se destruye la estructura
y existen malas condiciones desde el punto de vista físico.
Propiedades físicas. Los pH neutros son los mejores
para las propiedades físicas de los suelos. A pH muy ácidos
hay una intensa alteración de minerales y la estructura se vuelve
inestable. En pH alcalino, la arcilla se dispersa, se destruye la estructura
y existen malas condiciones desde el punto de vista físico.
![]() Propiedades químicas y fertilidad. La asimilación
de nutrientes del suelo está influenciadas por el pH, ya que determinados
nutrientes se pueden bloquear en determinadas condiciones de pH y no son asimilable
para las plantas. El pH también regula la actividad de los microorganismos del suelo.
Propiedades químicas y fertilidad. La asimilación
de nutrientes del suelo está influenciadas por el pH, ya que determinados
nutrientes se pueden bloquear en determinadas condiciones de pH y no son asimilable
para las plantas. El pH también regula la actividad de los microorganismos del suelo.
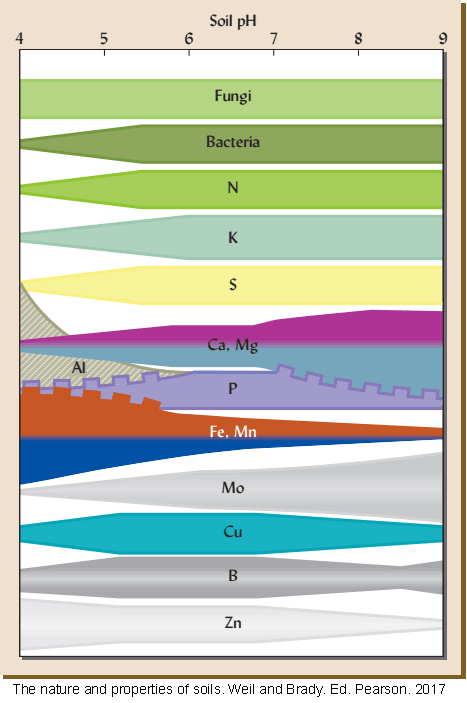
En el diagrama anterior puedes ver como los hongos no quedan afectados por el pH, mientras que las bacterias son sensibles a los pH ácidos. En cuanto a los nutrientes el N, K, S, Mo y en menor medida Ca y Mg tienen también sensibilidad a la acidez; Fe, Mn y Al son sólo solubles en suelos muy ácidos; Zn y Cu se encuentran insolubles en los suelos alcalinos; mientras que P, Cu y B son sensibles a los valores extremos de pH.
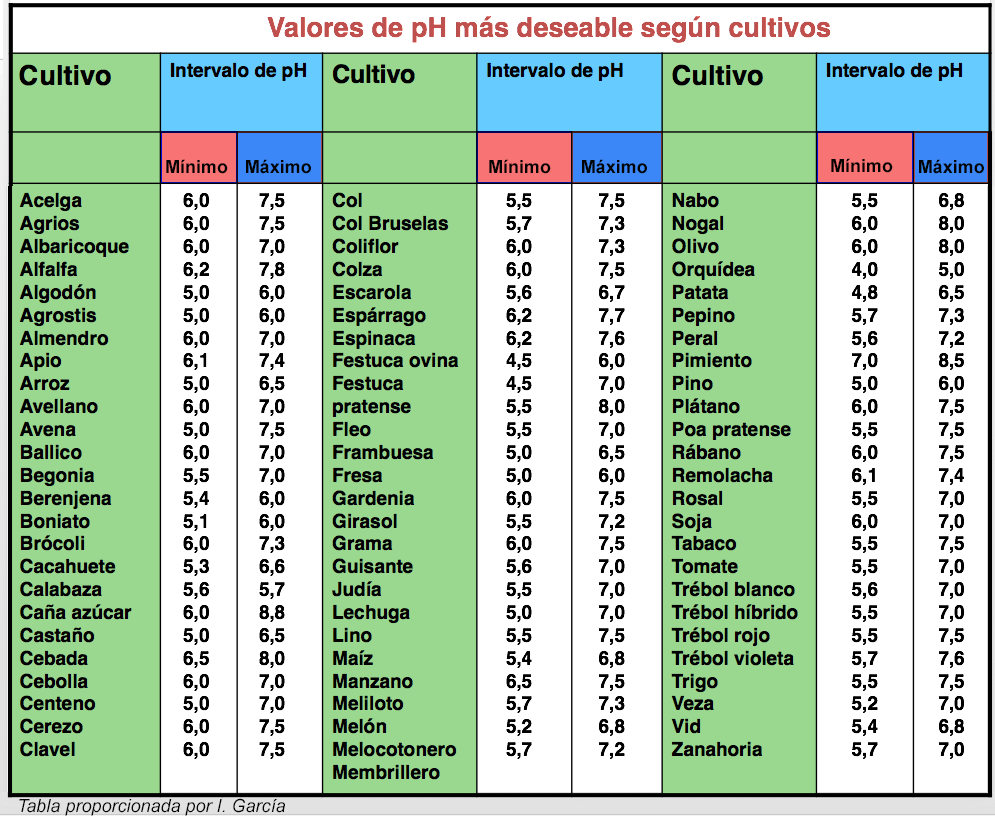
Con respecto a las plantas superiores, como te muestro en la siguiente figura, la mejor región de pH es alrededor de la neutralidad. En los suelos moderadamente y fuertemente ácidos sólo se podrán cultivar plantas acidófilas como el maíz, el centeno y la patata, mientras que en los ligeramente básicos y moderadamente básicos se pueden desarrollar especies basófilas como el arroz y la alfalfa. En suelos alcalinos con un pH por encima de 9 prácticamente no se pueden desarrollar ninguno de los cultivos tradicionales europeos.
3 Potencial de oxidación - reducción
Las condiciones de oxidación-reducción del suelo son de gran importancia para procesos de meteorización, formación de diversos suelos y procesos biológicos, también están relacionadas con la disponibilidad de ciertos elementos nutritivos.
La formulación química de las reacciones de oxidación-reducción es la siguiente:
ESTADO OXIDADO + ELECTRONES <=> ESTADO REDUCIDO
A ====> A+ + e- (se oxida)
B + e- ====> B- (se reduce)
Elementos reductores (A): presentan facilidad para oxidarse y ceder electrones.
Elementos oxidantes (B): elementos proclives a ganar electrones y reducirse.
SISTEMA REDOX: Conjunto de un oxidante y un reductor.
En el suelo existe un equilibrio entre los agentes oxidantes y reductores. La materia orgánica se encuentra reducida y tiende a oxidarse, es reductora, ya que al oxidarse tiene que reducir a otro de los materiales del suelo. Por el contrario el oxígeno es oxidante. Por otra parte hay muchos elementos químicos que funcionan con valencias variables, pudiendo oxidarse o reducirse según el ambiente que predomine.
Compuestos más importantes en estas reacciones:
Oxidante: Oxígeno (condiciones aerobias)
Reductor: M.O. (se oxida, libera energía para microorganismos y se origina el compuesto más oxidado: CO2)
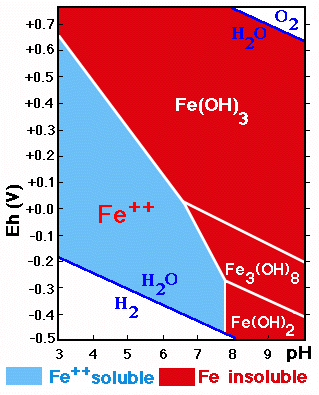
Los procesos de oxidación reducción envuelven a otros elementos que pueden actuar con diferentes valencias y entre ellos tenemos: Fe, Mn, S, N. Algunos ejemplos de procesos de de oxidación en el suelo son:
Oxidación: del Fe2+de minerales primarios en Fe3+ formando óxidos e hidróxidos Fe2+ ===> Fe3+ + e-;
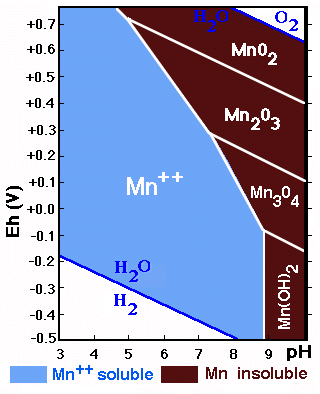
la transformación de Mn2+ en Mn4+;
la oxidación de S2-, por ejemplo de pirita, en sulfatos;
la nitrificación o sea la transformación de NH4 en nitritos y nitratos.
Por el contrario muchos procesos suceden bajo condiciones reductoras como:
la desnitrificación,
la desulfuricación,
la formación de compuestos Fe2+ y Mn2+.
POTENCIAL DE OXIDACIÓN (Eh): Es la capacidad oxidante de un sistema. Se mide en voltios (usualmente en milivoltios).
Sistemas más oxidantes que el hidrógeno: Eh positivo.
Sistemas más reductores que el hidrógeno: Eh negativo.
La reducción de elementos en el suelo al aumentar las condiciones anaerobias sigue la secuencia:
O2 NO3- Mn4+ Fe3+ SO42- CO2-
Un componente empezará a reducirse cuando todas las formas oxidadas con Eh superiores se hayan reducido

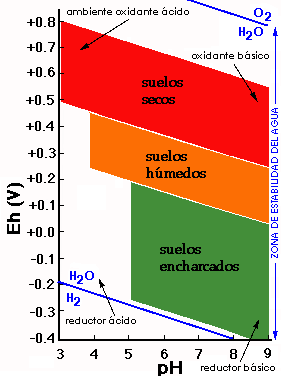
En los suelos normales el ambiente es aireado y por tanto la tendencia general es oxidante. En los suelos hidromorfos la saturación en agua tiende a provocar un ambiente reductor.
Los valores de pH y potencial redox (medidas Eh) delimitan los campos de estabilidad de los materiales del suelo. En sistemas naturales los límites superior e inferior de los potenciales redox vienen definidos por el límite de estabilidad del agua.
 *
*
Los compuestos de Fe y Mn son muy sensibles a cambios de pH y Eh.
 *
*
_________________
* figuras de origen desconocido
Programa | Lección 5 | Anterior | Siguiente | Principio página